
La trombofilia (chiamata a volte ipercoagulabilità o stato protrombotico) è un'anomalia della "Coagulazione del sangue" che aumenta il rischio di "Trombosi". Questo tipo di anomalia può essere riscontrato in circa il 50% delle persone che hanno avuto un episodio di trombosi (come la "Trombosi venosa profonda" nelle gambe) non provocato da altre cause. Una parte significativa della popolazione è affetta da questa anomalia diagnosticabile, ma la maggior parte di questi sviluppa la trombosi solo in presenza di altri fattori di rischio.
Non esiste un trattamento specifico per la maggior parte dei trombofiliaci, ma il verificarsi di episodi ricorrenti di trombosi può essere un'indicazione per prescrivere una terapia anticoagulante di lungo termine. La forma principale di trombofilia, la deficienza di antitrombina, fu identificata nel 1965 mentre le anomalie più comuni (incluso il fattore V di Leiden) furono descritte negli anni novanta.

La trombofilia è la tendenza ad avere eventi coagulativi con la formazione di trombi in conseguenza ad un determinato assetto genetico che si congiunge a fattori fisiologici (gravidanza, età avanzata), farmacologici (estroprogestinici, alti livelli di estradiolo) e patologici (stasi ematica per immobilizzazione degli arti, interventi chirurgici, patologie sistemiche).
Bisogna comprendere che tutti i molteplici fattori che determinano la coagulazione sono normalmente presenti nel circolo sanguigno ma non sono attivati e che comunque la loro azione è limitata ed ostacolata da fattori anticoagulativi. Ciò al fine di garantire una corretta coagulazione solo dove serve e per il tempo necessario.
La diagnostica di laboratorio è molto ampia e complessa e riguarda vari possibili test; il pannello della trombofilia in diagnostica assume sempre più importanza anche per il suo coinvolgimento nei fenomeni di poliabortività e nei protocolli di fertilizzazione in vitro.
Preparazione all'esame
E' necessario osservare un digiuno di almeno 8 ore, è ammessa l'assunzione di una modica quantità di acqua.
Tipo di provette in uso: provetta tappo azzurro (Plasma) - citrato di sodio
Tipo di provette in uso: provetta tappo viola - EDTA (acido etilendiamminotetraacetico) - SOLO SE GLI ESAMI VENGONO ESEGUITI PER BIOLOGIA MOLECOLARE COME ESTRAZIONE DEL DNA
Indicare al momento del prelievo se in : terapia anticoagulante, stato di gravidanza, cura per malattie del fegato o infezioni croniche come HIV.
Patogenesi

La trombosi è un problema multifattoriale perché esistono più cause che possono portare allo sviluppo di una trombosi. Questi fattori di rischio possono includere varie combinazioni di anomalie delle pareti dei vasi sanguigni, anomalie del flusso sanguigno (come l'immobilità) ed anomalie della viscosità del sangue.
La trombofilia è causata da anomalie della viscosità del sangue provocate dai livelli dei fattori di coagulazione e da altre proteine circolanti nel sangue che fanno parte del processo di emostasi.
Il Processo di coagulazione fisiologico è scatenato dal rilascio del fattore tissutale da parte dei tessuti danneggiati. Il fattore tissutale si lega al fattore VIIa circolante. Questa combinazione promuove il fattore X a fattore Xa e il fattore IX a fattore IXa. Il fattore Xa (in presenza del fattore V) attiva la protrombina in trombina. La trombina è un enzima chiave nel processo di coagulazione: genera la fibrina a partire dal fibrinogeno e attiva altri enzimi e cofattori (fattore XIII, fattore XI, fattore V e fattore VIII, TAFI) che accrescono il coagulo di fibrina. Il processo è inibito dal TFPI (che inattiva il primo passo catalizzato dal fattore VIIa/fattore tissutale), l'antitrombina (che inattiva la trombina, i fattori IXa, Xa e XIa).
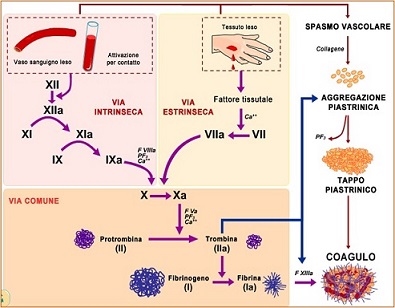
Nella trombofilia, il bilancio tra attività "procoagulante" ed "anticoagulante" è alterato. La gravità dello sbilanciamento è correlata alla probabilità che si sviluppi una trombosi. Anche una piccola perturbazione delle proteine, come la riduzione dell'antitrombina al 70-80% del livello normale, può aumentare il rischio di trombosi; questo la distingue dall'emofilia che si manifesta solo se i fattori di coagulazione sono notevolmente bassi.
Oltre agli effetti sulla trombosi, stati di ipercoagulabilità possono accelerare lo sviluppo dell'aterosclerosi, il disturbo arterioso che può causare l'infarto miocardico ed altre malattie cardiovascolari.
Segni e sintomi
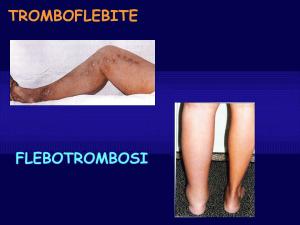
Le condizioni più comuni associate alla trombofilia sono la flebotrombosi e l'embolia polmonare (EP) spesso definite collettivamente come tromboembolia venosa.
La trombosi venosa profonda si manifesta solitamente nelle gambe con dolore, gonfiore ed arrossamento dell'arto. Può comportare una condizione di gonfiore e pesantezza a causa dei danni alle valvole nelle vene. Il coagulo potrebbe staccarsi e spostarsi (embolia) nelle arterie polmonari. In base alla dimensione ed alla posizione del coagulo, questa si manifesta con dispnea, dolore al torace, palpitazioni e può avere come complicanze shock ed arresto cardiaco.
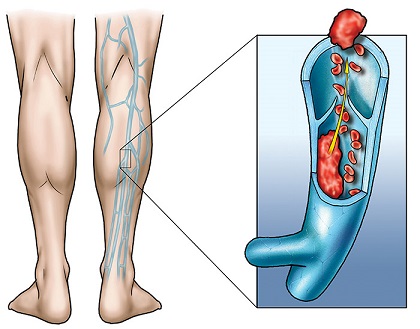
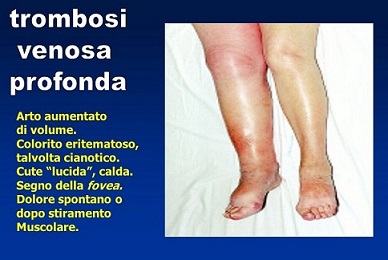
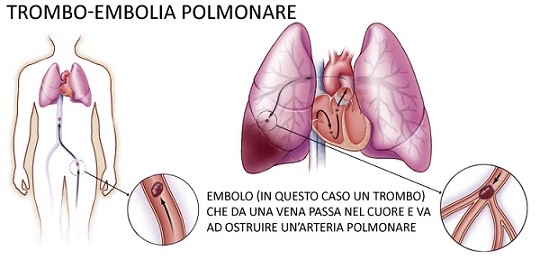
La trombosi venosa può manifestarsi in vari distretti del corpo: nelle vene cerebrali, nel fegato (trombosi della vena porta e trombosi della vena epatica), nelle vene mesenterica superiore e mesenterica inferiore, nel rene (trombosi della vena renale) e nelle braccia (sindrome di Paget-von Schroetter). Non è ancora chiaro se la trombofilia aumenta il rischio di trombosi arteriosa (che è una delle cause di infarto miocardico).

La trombofilia è stata collegata a casi di aborto spontaneo ripetuto e ad altre complicanze della gravidanza come una ridotta crescita fetale, morte fetale, preeclampsia e l'abruptio placentae.
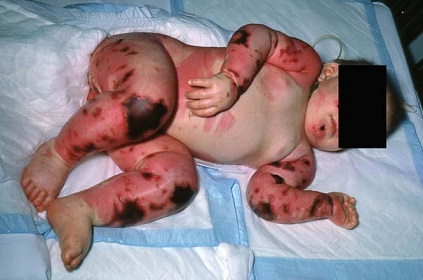
Il deficit di proteina C nel neonato può causare la purpura fulminans, un grave disturbo della coagulazione, che porta alla morte dei tessuti ed a emorragie nella pelle ed in altri organi. Questa condizione è stata riportata anche negli adulti. La deficienza di proteina C e proteina S è stata associata anche ad un aumento della necrosi della pelle o all'inizio di trattamenti anticoagulanti col warfarin od altri farmaci simili
Trattamento
Non esiste un trattamento specifico per la trombofilia, a meno che non sia causata da altre malattie (come la sindrome nefrotica), in questo caso si tratta la malattia di base. Negli individui affetti da trombosi ricorrenti o senza una causa apparente o in quelli con alto rischio di trombofilia, la decisione più importante è se consigliare l'uso di anticoagulanti come il warfarin per lunghi periodi in modo da ridurre il rischio di ulteriori episodi. Questo rischio dev'essere confrontato con quello di emorragie causate dai farmaci, dal momento che il rischio di gravi emorragie è del 3% all'anno e l'11% di queste può causare la morte.
Oltre alle forme di trombofilia menzionate precedentemente, il rischio di ricorrenza dopo un episodio di trombosi è determinato da fattori come l'estensione e la gravità della trombosi originaria, se ha avuto una causa (come l'immobilità o la gravidanza), il numero di eventi trombotici, il sesso maschile, la presenza di un filtro della vena cava inferiore, la presenza di cancro, sintomi della sindrome post-trombotica e l'obesità. Questi fattori tendono ad assumere maggior importanza nella decisione che la presenza o l'assenza di una trombofilia sia diagnosticabile.
Le donne affette da trombofilia che desiderano un bambino o che sono incinte solitamente hanno bisogno di terapie alternative al warfarin durante la gravidanza, soprattutto nelle prime 13 settimane perché potrebbe causare anomalie fetali. L'eparina a basso peso molecolare (LMHW come l'enoxaparina) è utilizzata genericamente come sostituto. Il warfarin e l'LMWH possono essere utilizzati anche durante l'allattamento.
Prognosi
Nelle persone non affette da una trombofilia diagnosticabile, il rischio cumulativo di sviluppare una trombosi fino all'età di 60 anni è di circa il 12%. Circa il 60% degli individui affetti da deficienza di antitrombina accuseranno almeno un evento di trombosi entro i 60 anni d'età, così come circa il 50% degli affetti da deficienza di proteina C e circa un terzo degli affetti da deficienza di proteina S. Gli individui affetti da resistenza alla proteina C attivata (solitamente conseguenza del fattore V di Leiden), presentano solamente un piccolo aumento di rischio, con circa il 15% di probabilità di incorrere in un episodio di trombosi entro i 60 anni d'età. In generale, gli uomini hanno una maggior probabilità di incorrere in ripetuti episodi di trombosi.
Le persone affette dal fattore V di Leiden presentano un basso rischio relativo di trombosi ma potrebbero sviluppare una trombosi in presenza di fattori di rischio addizionali come l'immobilizzazione. La maggior parte delle persone con la mutazione della protrombina (G20210A) non svilupperanno mai una trombosi.
I test per la trombofilia comprendono l'emocromo (con esame dello striscio), i tempi di protrombina, tromboplastina parziale, trombina e reptilasi, l'anticoagulante lupico, l'anticorpo anti-cardiolipina, l'anticorpo anti-β2 glicoproteina 1, la resistenza alla proteina C attivata, i test del fibrinogeno, il fattore V di Leiden, le mutazioni della protrombina ed i livelli di omocisteina basale. I test possono essere più o meno approfonditi a seconda del giudizio clinico e della presenza di altre anomalie in fase di valutazione iniziale.
Proteina S coagulativa - Proteina C coagulativa - Resistenza alla proteina C attivata
La proteina S è un fattore del sangue che limita la coagulazione tramite la degradazione dei fattori V e VIII e nel far ciò agisce insieme ad un’altra proteina detta C coagulativa. In effetti la proteina S è efficace solo se non è legata (libera) ad un’altra proteina detta C4b, per questo motivo si parla di S coagulativa libera. La percentuale di S libera è circa il 40% mentre il 60% è legata. Una bassa percentuale di S libera costituisce uno dei fattori predisponenti la trombofilia.
Sono descritte tre condizioni a riguardo, la prima è dovuta ad una quantità globale di proteina S insufficiente, la seconda è dovuta ad una bassa attività della proteina, la terza ad un eccesso della componente legata a scapito della libera.
Queste condizioni possono essere su base genetica, anche se in forma rara, o acquisite come nel caso di patologie epatiche, sindrome nefrosica, eccessivo utilizzo della proteina S per episodi coagulativi o, più comunemente, bassi livelli di vitamina K o terapie con estroprogestinici.
La proteina C coagulativa, che come abbiamo detto coopera con la proteina S, regola la velocità di formazione dei trombi limitandone la loro estensione, la sua attivazione deriva da un fattore coagulativo detto trombina che si lega alla proteina trombomodulina ed attiva la proteina C. Proprio la proteina C attivata legandosi al suo cofattore proteina S accelera la degradazione dei fattori V e VIII che sono le sostanze che attivano la trombina stessa. Anche la proteina C, come la S, può essere carente per fattori congeniti, iperconsumo, carenza di vitamina K, assunzione di estroprogestinici o alti livelli di estradiolo per induzione dell’ovulazione. Le carenze congenite di proteina C possono essere da deficit di sintesi o sintesi di proteine con ridotta attività biologica per ridotta capacità di legarsi alla proteina S o per ridotta capacità di degradazione dei fattori V e VIII.
E’ interessante anche la valutazione della resistenza alla proteina C attivata, si tratta di un test coagulativo in cui si aggiunge al sangue da esaminare quantità crescenti di proteina C attivata assistendo pertanto ad un progressivo allungamento dei tempi di coagulazione. Se ciò non avviene si ha la resistenza alla proteina C attivata determinata dalla mutazione del Fattore V detto di Leiden.
Fattore V di Leiden
Il Fattore V determina, una volta attivato, la conversione del fattore II in trombina; questo fenomeno viene ostacolato dalla proteina C coagulativa, in concorso con la proteina S, tramite la degradazione del fattore V che viene separato in due frammenti inattivi detti Vi9. Uno dei punti di separazione avviene a livello di una arginina posta in posizione 506. Esiste una variante genetica, legata al cromosoma 1, in cui questa arginina viene sostituita da un altro aminoacido , la glutammina, il che comporta l’impossibilità da parte della proteina C coagulativa attivata di effettuare la lisi del fattore V determinando la condizione di resistenza alla proteina C attivata (APC resistenza). Questa condizione è detta Fattore V di Leiden, dal nome della località olandese in cui fu per la prima volta descritta, o variante G1691A e può essere presente sia, più raramente, nella condizione di omozigosi che in quella, più frequentemente, di eterozigoti.
Omozigosi: condizione in cui ci sono alleli identici per un singolo gene (nello specifico per il gene che codifica il Fattore V)
Eterozigoti: condizione in cui ci sono alleli diversi per un singolo gene
Alleli: coppia di geni presenti su due cromosomi omologhi (uno di origine paterna ed uno materna) che codificano lo stesso carattere.
In questi soggetti aumenta il rischio di eventi trombotici e di poliabortività, si calcola che l’aumento del rischio nei soggetti in eterozigosi sia circa 5 - 10 volte superiore ai soggetti sani mentre per quelli in omozigosi il rischio di un evento trombotico è circa 80 volte superiore. L’incidenza di questa mutazione è alquanto alta, si calcola che in Europa sia presente in circa il 5% della popolazione per l’eterozigosi e allo 0,02 – 0,05% in omozigosi, non c’è differenza di incidenza tra maschi e femmine.
Gli interventi chirurgici, la stasi ematica, la gravidanza e gli estroprogestinici sono fattori che incrementano il rischio.
Gene Protrombina
La Protrombina o Fattore II viene attivato in trombina portando alla formazione del fibrinogeno in fibrina; è uno dei punti chiave della coagulazione ed è descritta una mutazione genetica che la interessa (G20210A) con conseguente aumento dei livelli di protrombina e rischio trombofilico.
Si presenta anch’essa sia in eterozigoti che in omozigosi con una incidenza relativamente bassa.
Omocisteina
L’omocisteina è un amminoacido che gioca un ruolo di primissimo piano tra i fattori predisponenti alla trombofilia e quindi al rischio cardiovascolare e a fenomeni di poliabortività. I livelli ematici di omocisteina sono regolati da vari fattori che interagiscono tra loro, in particolare il quadro genetico, i fattori nutrizionali vitaminici, le abitudini di vita ed eventuali patologie renali. Infatti il basso introito di acido folico ed in parte di B12 e B6, il fumo di sigaretta, la vita sedentaria e l’insufficienza renale sono tutti fattori di incremento dei valori ematici che vanno ad enfatizzare eventuali anomalie genetiche. Non si conoscono ancora tutti gli effetti negativi di questo aminoacido sull’endotelio vascolare e sui meccanismi coagulativi ma sembra che vi sia una tossicità diretta contro l’endotelio. Inoltre l’omocisteina agisce sul fattore V e sul suo regolatore proteina C coagulativa. Attualmente non si conosce il motivo dell’incremento dell’omocisteina nell’insufficienza renale.
L’omocisteina deriva dal metabolismo della metionina, infatti come tale non è presente negli alimenti, ed un’alta assunzione alimentare di metionina può indurre lievi ma transitori aumenti dell’omocisteina, comunque la metionina è presente in moltissimi alimenti sia di origine vegetale che, in misura maggiore, animale. Per degradare l’omocisteina esistono due differenti vie cataboliche, la prima detta trans-sulfurazione che determina la formazione di cisteina un metabolita non tossico grazie all’azione di un enzima detto cistationina beta sintetasi. Il deficit congenito di questo enzima è molto raro ma determina elevatissimi livelli di omocisteina con conseguenze spesso fatali. L’altra via metabolica è la rimetilazione in cui l’omocisteina rientra nella formazione di metionina; perché ciò avvenga è assolutamente necessaria l’azione dell’acido folico e anche delle vitamine B6 e B12. E’ inoltre necessaria una specifica attività legata ad un enzima detto MTHFR.
MTHFR
L’MTHFR è la sigla della metilentetraidrofolatoreduttasi, enzima coinvolto nella rimetilazione dell’omocisteina a metionina. La mutazione più frequente riferita a questo enzima è chiamata C667T e determina aumento dei valori di omocisteina; può essere presente sia in eterozigoti che in omozigosi con una incidenza molto alta nella popolazione. Accanto alla mutazione C667T è stata descritta la mutazione A1298C che determina anch’essa l’aumento dell’omocisteina ed infine una grave deficit dell’attività dell’MTHFR trasmessa su base autosomica recessiva con riduzione quasi totale dell’attività enzimatica con esiti infausti ma fortunatamente con incidenza molto rara nella popolazione.
D-Dimero
Tutte le alterazioni descritte determinano eventi trombotici che possono essere monitorate con il dosaggio del D-Dimero, si tratta di un prodotto della degradazione della fibrina e pertanto la sua presenza indica che sia i fenomeni coagulativi che quelli di fibinolisi sono stati attivati. Le concentrazioni di D-Dimero aumentano anche in moltissime condizioni come l’età avanzata, la gravidanza, le malattie reumatiche, le malattie infiammatorie in genere, neoplasie, traumi, ustioni, scompenso cardiaco, crisi emolitiche, malattie epatiche e renali. E’ evidente che in presenza di un numero così alto di condizioni influenzanti il D-Dimero, esso debba essere utilizzato per escludere e non per confermare un evento coagulativo. In altre parole un D-Dimero negativo può ragionevolmente escludere una coagulazione in atto, viceversa la presenza di un D-Dimero positivo non è probante per la conferma di un sospetto evento trombotico.

Le trombofilie ereditarie (predisposizione genetica alla trombosi) sono un gruppo di patologie caratterizzate dalla tendenza a soffrire di episodi trombotici.
Nella maggior parte dei casi si tratta di difetti o alterazioni di uno o più fattori della coagulazione del sangue dovute a mutazioni puntiformi di un singolo nucleotide nei geni che codificano per essi. Queste mutazioni sono presenti con una tale frequenza nella popolazione da essere considerate dei polimorfismi. Lo studio di tali polimorfismi è indicata in soggetti con precedenti episodi di tromboembolismo venoso o trombosi arteriosa, donne che intendono assumere contraccettivi orali, soggetti diabetici, ma anche in donne con precedenti episodi di trombosi in gravidanza o donne con poliabortività . Studi recenti infatti si orientano verso una connessione tra la genetica dei fattori della coagulazione e i fenomeni di abortività. Le donne sofferenti di trombofilia ereditaria, eccessiva coagulazione causata da un’anomalia genetica, sono infatti la categoria più a rischio di aborto in utero a gravidanza avanzata. Nella maggior parte dei casi la morte del feto è causata da alterazioni geniche di uno o più fattori della coagulazione del sangue che determinano l’istaurarsi di una trombosi plancentare, caratterizzata da un’ostruzione dei vasi sanguigni placentari. Da un punto di vista della trasmissione genetica, la maggior parte dei difetti trombotici si presenta in forma eterozigote e si trasmette con modalità autosomica dominante a penetranza incompleta. Le persone affette hanno una possibilità su due di trasmettere la predisposizione alla malattia ai figli, indipendentemente dal sesso. In gravidanza una condizione genetica di eterozigosi o omozigosi per uno o più di questi geni è considerata predisponente all’aborto spontaneo.
SONO DI SEGUITO ELENCATE ALCUNE DELLE MUTAZIONI PIU’ COMUNI RELATIVE AL RISCHIO TROMBOTICO:
Il Fattore V attivato è un cofattore essenziale per l’attivazione della Protrombina (Fattore II) a Trombina. Il sue effetto pro-coagulante è normalmente inibito dalla Proteina C attivata, che taglia il fattore V attivato in tre parti. Un sito di taglio è localizzato nell’aminoacido arginina alla posizione 506. Una mutazione G1691A del gene che codifica per il Fattore V a livello della tripletta nucleotidica che codifica per l’arginina in 506 (nucleotide 1691) con sostituzione di una G (guanina) con una A (adenina), comporta la sostituzione dell’arginina con un altro aminoacido, la glutammina, che impedisce il taglio da parte della Proteina C attivata. Ne consegue una resistenza alla Proteina C attivata (APC) ed una maggiore attività pro-coagulante del Fattore V attivato che predispone alla trombosi. Tale variante G1691A è definita variante di Leiden (località in cui fu scoperta) ed ha una frequenza in Italia dei portatori in eterozigosi pari al 2-3%, mentre l’omozigosità per tale mutazione ha un’incidenza di 1:5000. I soggetti eterozigoti hanno un rischio 8 volte superiore di sviluppare una trombosi venosa, mentre gli omozigoti hanno un rischio pari ad 80 volte. Tale evento trombotico è favorito in presenza di altre condizioni predisponenti quali la gravidanza, l’assunzione di contraccettivi orali (rischio aumentato di 30 volte negli eterozigoti e di alcune centinaia negli omozigoti), gli interventi chirurgici. In gravidanza una condizione genetica di eterozigosi per il Fattore di Leiden è considerata predisponente all’aborto spontaneo, alla eclampsia, ai difetti placentari, alla Sindrome di HELLP (emolisi, elevazione enzimi epatici, piastrinopemia). I soggetti portatori di mutazione del Fattore V di Leiden dovrebbero pertanto sottoporsi a profilassi anticoagulativa in corso di gravidanza o in funzione di interventi chirurgici ed evitare l’assunzione di contraccettivi orali.
Recentemente sono stati ndividuati altri 2 polimorfismi del Fattore V associati a trombofilia. La prima, H1299R,(A4070G) aplotipo HR2, consiste nella sostituzione di una adenina con una guanina in posizione nucleotidica 4070 nell’esone 13 e comporta a livello proteico l’inserimento di una arginina al posto di una istidina in posizione aminoacidica 1299. La seconda, Y1702C,(A5279G), consiste nella sostituzione di una adenina con una guanina in posizione 5279 del gene e comporta a livello proteico la sostituzione di una tirosina con un residuo di cisteina in posizione 1702 del Fattore V della coagulazione. Tali polimorfismi, se associati al Fattore V di Leiden, aumentano il rischio di trombosi ed in particolare la mutazione Y1702C rafforza la resistenza alla proteina C attivata nei portatori della mutazione R506Q (Leiden) o H1229R aplotipo HR2. La doppia eterozigosità per la mutazione di Leiden e HR2 conferisce un fattore di rischio di tromboembolismo di 3-4 volte superiore rispetto alla presenza della sola mutazione di Leiden. Non si nota aumento di rischio quando l’aplotipo HR2 è associato ad altre mutazioni.
POLIMORFISMO G20210A CORRELATO AL FATTORE II DELLA PROTOMBINA
Protrombina o Fattore II della coagulazione svolge un ruolo fondamentale nella cascata coagulativa in quanto la sua attivazione in trombina porta alla trasformazione del fibrinogeno in fibrina e quindi alla formazione del coagulo. E’ stata descritta una variante genetica polimorfismo G20210A comune nella regione 3’UTR (cromosoma 11) del gene della Protombina che è associata ad elevati livelli di protrombina funzionale nel plasma e conseguente aumentato rischio di trombosi, specie di tipo venosa. Trattasi di una sostituzione di una G (guanina) con una A (adenina) alla posizione 20210 (G20210A). La frequenza genica della variante è bassa (1,0-1,5%) con una percentuale di eterozigosi del 2-3%. L’omozigosi è rara. Per gli eterozigoti c’è un rischio aumentato di 3 volte di sviluppare una trombosi venosa, di 5 volte per l’ictus ischemico, di 5 volte per infarto miocardico in donne giovani, di 1,5 volte per gli uomini, di 7 volte nei diabetici, di 10 volte per trombosi delle vene cerebrali e di 149 volte in donne che assumono contraccettivi orali.
MTHFR 1 (C677C) gene Metilentetraidrofolatoreduttasi
MTHFR 2 ( A1298C) gene Metilentetraidrofolatoreduttasi
La metilentetraidrofolatoreduttasi (MTHFR) è un enzima coinvolto nella trasformazione del 5-10 metilentetraidrofolato in 5 metiltetraidrofolato che serve come donatore di metili per la rimetilazione della omocisteina a metionina tramite l’intervento della vitamina B12. Rare mutazioni (trasmesse con modalità autosomica recessiva) possono causare la deficienza grave di MTHFR con attività enzimatica inferiore al 20% e comparsa di omocisteinemia, omocistinuria e bassi livelli di acido folico. La sintomatologia clinica è grave con ritardo dello sviluppo psico-motorio e massivi fenomeno trombotici. Il gene per la metilen-tetraidrofolatoreduttasi (MTHFR) si trova sul braccio corto del cromosoma 1. Associato alla deficienza grave di MTHFR è stato identificato un polimorfismo genetico comune, dovuto alla sostituzione di una C (citosina) in T (timina) al nucleotide 677 (C677T), che causa una sostituzione di una alanina in valina nella proteina finale ed una riduzione dell’attività enzimatica della MTHFR pari al 50%, fino al 30% in condizioni di esposizione al calore (variante termolabile). Il danno ed il rischio vascolare da iperomocisteinemia sono graduali e continui e non esiste una soglia discriminante il rischio dal non-rischio. Negli ultimi anni si vanno accumulando sempre maggiori evidenze scientifiche su come livelli clinicamente aumentati di omocisteina rappresentino un nuovo fattore indipendente di rischio cardiovascolare che si può affiancare agli altri fattori di rischio tradizionali o che può potenziarne gli effetti deleteri sulla parete arteriosa. L’omocisteina sembrerebbe indurre il danno vascolare interferendo con la produzione di acido nitrico da parte dell’endotelio, determinando iperplasia delle cellule muscolari lisce e aumentando la produzione di radicali liberi con conseguente danno ossidativo e perossidazione lipidica (così favorendo la formazione della placca aterosclerotica), nonchè interferendo con la funzione piastrinica e incrementando la tendenza alla trombosi. L’iperomocisteinemia riveste inoltre importanti implicazioni nella riproduzione umana connesse al momento concezionale (aborti ripetuti), allo stato gravido (patologie vasculodipendenti quali preeclampsia, difetto di crescita fetale, distacco di placenta) e alla menopausa. Si è calcolato che un incremento di 5 μmoli/l di omocisteina causa un aumento di 7 volte del normale rischio di arteriopatie periferiche e di 2,6 volte del normale rischio di trombosi venosa agli arti (soprattutto in persone giovani, sotto i 40 anni e donne). Un’altra alterazione del gene MTHFR, la sostituzione di una adenina con una citosina in posizione 1298 del gene (A1298C) è stata associata ad una diminuizione dei livelli di MTHFR. In particolare, i soggetti portatori in omozigosi mantengono un’attività enzimatica pari al 60% mentre i doppi eterozigoti (portatori di entrambe le mutazioni C677T e A1298C) conservano un’attività pari al 50-60%. Le mutazioni C677T e A1298C rappresentano tuttavia un fattore di rischio cardiovascolare solo in soggetti con basso status di folati: ciò sottolinea l’importanza sia nella prevenzione che nella terapia dell’apporto nutrizionale dell’acido folico, il cui deficit risulta un cofattore patogeno necessario. Il rischio relativo per il tromboembolismo venoso dovuto ad una diminuita attività dell’MTHFR può aumentare in condizione di doppia eterozigosi, specie con la variante di Leiden del Fattore V o con la variante G20210A della Protrombina.